|
合衆国最高裁判決 Amgen v. Sanofi事件 米国特許法第112条(a)項の明細書に課せられた「実施可能要件」 US Supreme Court decision on Enablement
under 35 U.S.C. 112(a) Summarized by Tatsuo YABE – 2023-05-22 |
去る3月27日の口頭審理を経て、2023年5月18日、合衆国最高裁で表題の件に関する判決がでました。米国特許法第112条(a)項の明細書に課せられた「実施可能要件」に関するもので1952年に立法されて最高裁が取り上げるのは初めてです。一言で云うと最高裁はAmgenの特許クレームは112条(a)項の実施可能要件を満たさないとした地裁・CAFCの判決を認容しました。本判決の根拠として最高裁は自身の実施可能要件に関する過去の4件の判決(1840年代~1920年代)を引用しこれらは古い判決ではあるが法理論はAmgenのバイオの技術にも問題なく適用されるとし、26通りの抗体(Species)しか明細書に開示していないのに拘わらずクレームはPCSK9に結合し、当該PCSK9が幹細胞に発現するLDL受容体と結合することを阻止する抗体のクラス全体(Genus)に権利を求めるのは、特許権者に付与される権利(一定期間の排他権)と公共の利益(明細書の開示から発明を実施できる)とが釣り合わないとし実施可能要件違反とした。
上記最高裁判決は予想されていた通りで、過去のCAFC判決との整合性を欠くものではないので実務に(出願実務及び権利行使)大きな影響を与えるものではないと考える。即ち、特に、予見不能な技術分野において、実施例に鑑み広すぎるクレームは実施可能要件違反とし出願審査で拒絶されるか、或いは、訴訟で無効にされやすいということだ。
ということは112条(a)項の「記述要件(written description)」との違いは何だろうか? 本最高裁において112条(a)項の「実施可能要件(“enablement”)」と「記述要件(“written description”)」との関係は争点になっていないし、最高裁はそれらの関係について一切言及していない。しかし、2010年のCAFC大法廷判決(Ariad v Eli-Lilly [9:2])においては112条(a)項の「記述要件」は「実施可能要件」とは識別される要件であり、クレームされた発明を発明者が出願時に実際に所有していたことを当業者が合理的に理解できるように明細書に記載しなければならないとした。当時この判決を踏まえて(特に予見不能な技術分野において)実施例に対して広すぎるクレームは記述要件違反として審査で拒絶或いは訴訟で無効とされると理解された。筆者にとってはどうもこの点(112条(a)項の記述要件と実施可能要件との差)が釈然としない。言い換えると、実施可能要件と満たすが記述要件を満たさない明細書とは?
化学、バイオ関係の技術分野以外の方々は文末の簡単なん技術説明を参照ください。(以上筆者)
[事件の背景]
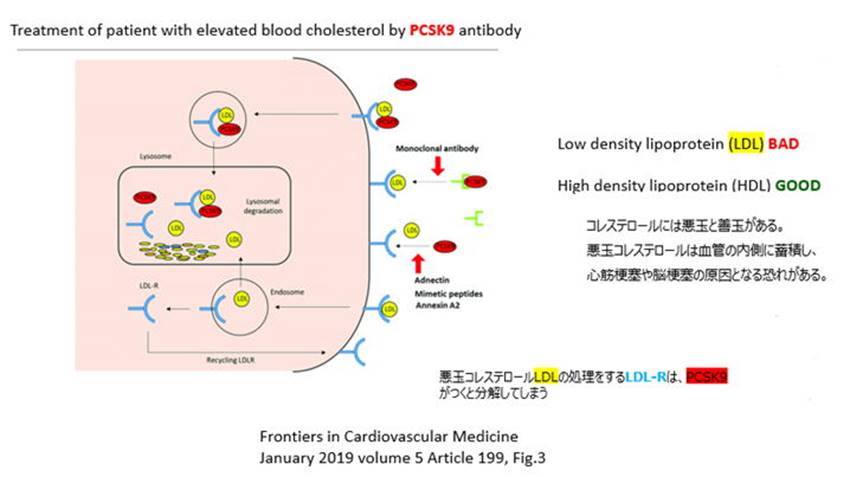
ご存じのようにコレステロールには悪玉(LDL)と善玉(HDL)があり、LDL(悪玉コレステロール)は幹細胞に吸収されると血管の内側に蓄積し心筋梗塞や脳梗塞のリスクを高める可能性がある。悪玉コレステロール(LDL)は幹細胞の表面に発現するLDL受容体で保持され処分される。しかし、PCSK9というプロテイン(体内で自然に生成される)がLDL受容体と結合すると受容体の機能を阻害しLDLが幹細胞に吸収され血管の内側に蓄積するという状態となる。これを避けるためAmgen社はPCSK9と結合(binding)し、PCSK9がLDL受容体と結合することを阻止(blocking)する26種のアミノ酸のシーケンス(抗体)を見出した。Amgenは、この抗体をPCSK9阻害薬(PCSK9-inhibiting
drug)としてRepathaという薬品名で販売し、SanofiはPraluentという薬品名で販売していた。
Amgenの特許においては自社が製造した26種のアミノ酸のシーケンス(抗体)をクレームするのではなく、PCSK9と結合(binding)し、PCSK9がLDL受容体と結合することを阻止(blocking)する全てのクラスの抗体(SpeciesではなくGenus)を権利範囲としクレームした。Amgen特許の明細書には26種のアミノ酸のシーケンスとそのうち2種類のアミノ酸に対応する3次元の構造が開示されている。
2014年にAmgenはSanofiを相手に特許侵害裁判を起こした。Sanofiは、Amgen特許は112条(a)項の「実施可能要件」を満たさないので無効であると反論した。即ち、112条(a)項においてクレームされた発明を当業者が実施できるように明白、簡潔に、正確な用語を用いて説明することと規定されている。しかしAmgenの明細書ではそれら抗体を生成するのに試行錯誤を繰り返すという程度にしか説明されていないにも拘わらず、Amgenは潜在的には百万通りにも及ぶアミノ酸のシーケンス(抗体)に対する権利(排他権)をクレームしている。地裁とCAFCはSanofiの主張を認め、Amgenのクレームは米国特許法112条(a)項の「実施可能要件」を満たさないとし無効と判断した。
[最高裁での争点]
Amgenの特許クレームは112条(a)項の実施可能要件を満たすか?
以下の理由によってAmgen特許のクレームは実施可能要件を満たさない:
[a] 特許法における契約とは、特許権者が自身の新規なる発明を公共に開示するという行為に対する対価として一定期間の排他権を享受することである。1790年に最初の特許法が立法されてから連邦議会で幾度もの改訂を経るもののこの規定(考え方)は維持されてきた。それは特許権者が明細書で周知なるもの(従来技術)と識別されるということを記載するだけではなく、当業者が明細書を参酌すると発明を実施できるというように記載するという要件であり、この要件(実施可能要件)は特許法の改訂を経てもほぼ変更されることなく今日に至った。
最高裁は過去にも実施可能要件に関して事件を審理し判決を下した。例えば、O’Reilly v. Morse事件(1854年)、Incandescent Lamp Patent(1895年)、Minerals Separation(1916年)、Holland Furniture v. Perkins Glue(1928年)がある。これら事件において、もし特許がプロセス、機械、製造物、或いは、物の組成に対するクラスの全てをクレームしている場合には、特許の明細書はそのクレームされたクラス全体に対して当業者が製造及び使用できるように記載されていなければならない。
Morse事件において、Morse特許にはクレームが8項あり、クレーム1~7は権利を認められたが、唯一クレーム8は電気通信システム全体に対するものであり、当該クレーム8の権利範囲は広すぎて、法の下に許容できるものでないと最高裁が判断した。即ち、Morse特許の当該クレーム8は電気通信システムの全体を請求していたが明細書はそのシステムに入る全てを実施可能にする記載は存在しなかった。最高裁曰く、もしクレーム8に権利を認めるのであれば明細書自身が必要なくなる。
Incandescent Lamp事件において、炭化した紙を導電体として用いたランプを発明した発明者は特許のクレームにおいて、導電体を当該炭化した紙に限定するのではなく、全ての繊維及び織物素材を含むようにクレームした。当該クレームを侵害しているとし、竹を導電体とするランプを発明したトーマス・エジソンを特許侵害として訴えた。最高裁において、もし当該特許明細書において広くクレームされた繊維素材及び織物素材の共通する性質を特定し、白熱灯の導電材として適応される特異性を説明していれば、当該特許は裁判でも有効と判断されたであろう、しかし、明細書にそのような記載はなかった。事実、Incandescent Lampに開示された炭化した紙も導電体として実用性には乏しく、殆どの繊維・織物素材も白熱灯の導電体としてはうまく機能しなかった。唯一、痛ましいほどの努力と苦労の末に京都八万男山に生育していた竹が最良の素材であることをエジソンのチームが発見し、その後その竹を栽培する特定の農家より米国に輸入するに至った。
Holland Furniture事件において、当時ベニヤ板の製造過程において動物性の糊を使用するのが良いと理解されていた。その代替品としてPerkins Glue社は当該動物性の糊と同程度の機能性を持つ特定のでんぷん糊を開発したが、同社は当該特定のでんぷん糊ではなく全てのでんぷん糊を含むようにクレームした。明細書には当該でんぷん糊に対する物性或いは化学成分を説明するのではなく、その使用方法及び機能を説明していた。最高裁は、当該クレームは実施可能要件を満たさないので無効と判断した。
上記したことによって、明細書は常にクレームされたクラスに含まれるすべての実施形態を製造且つ使用可能に詳述しなければならないという意味ではない。例えば、明細書にクレームされたクラスの全体に共通する一般的な性質、「特定の目的に対する特定の適合性」と理解される・・・を説明していれば明細書の開示は十分と理解されるであろう。さらには、明細書の説明を基に当業者が発明を実施するのに幾分かの応用、或いは、実験を必要とするからということで当該明細書の開示は不十分であるとは判断されない。Minerals Separation事件でも判示したように、実施可能要件を満たす明細書の開示のレベルとは、当業者が発明を実施するのに合理的な回数実験(a reasonable amount of experimentation)を必要とするレベルでも良い。ここで言う「合理的な(reasonable)」とは技術分野及び従来技術によって事案毎に判断される。
[b] Amgenの特許クレームは、明細書で開示されたアミノ酸配列で特定された26 種類の抗体を遥かに超えた広い範囲の抗体全てを包括するように規定している。Amgenの明細書はその広範なクレームの範囲を実施可能とするものではなく、妥当な実験により発明の実施を許容するものでもない。Amgenのクレームは上記した3件の最高裁判決における広範なクレームを遥かに超える広さと理解される。上記したように、Amgenの問題となったクレームは、PCSK9の好都合な箇所(Sweet spot)に結合し(binding)、当該PCSK9が幹細胞のLDL受容体に結合することを阻止する(blocking)という機能を規定することで、これら機能を実現する抗体の全てに排他権を得ようとしている。しかし裁判の記録からも明らかなようにそのような機能を実現する抗体はAmgenの明細書で開示された僅か26種類に限定されるものではない(それより遥かに多い)。
Amgenは当業者であれば明細書を参酌し、それをロードマップ(roadmap)或いは従来の置換法(conservative substitution)によって当該機能を実現する全ての抗体を発見することが可能であると主張している。しかしここで言う2つの手法は2つの研究課題を提示しているのと等しい。Amgenの主張するロードマップとはAmgen自身がAmgen特許クレームの2つの機能(“binding” and “blocking”)を実現する抗体を発見するのに実行した試行錯誤以上の何物でもない。Amgenの主張する従来の置換法に関しても研究者が2つの機能(“binding” and “blocking”)を実現に成功したアミノ酸を基礎とし、当該アミノ酸と類似した性質を持つアミノ酸に置換し、その置換された配列が2つの機能を実現できるかをテストするということである。
Amenはさらに当業者がクレームされた発明の全体を実施する上で結果的に掛かる時間が長いからと言うことで実施可能要件を判断するのは間違いであると主張した。CAFCもAmgenのこの主張自体を否定しているわけではない。即ち、合計でどれだけの時間を費やしクレームされた発明の全体を実施するのに要したかは実施可能要件を満たすか否かの判断にとっての確定的な判断基準ではない。
Amgenはさらに実施可能要件は唯一米国特許法第112条(a)項に規定されているのに拘わらずCAFCは同条文を超えたより厳格な基準を判示していると主張した。しかし同CAFCの判断は米国特許法112条を起草した連邦議会の立法趣旨に合致するものである。
[結論]
CAFC判決を認容する。
*********************************************************************************
References:
問題となったAmgen特許のクレーム:
USP
8,829,165
1. An isolated monoclonal antibody, wherein, when bound to PCSK9, the
monoclonal antibody binds to at least one of the following residues: S153,
I154, P155, R194, D238, A239, I369, S372, D374, C375, T377, C378, F379, V380,
or S381 of SEQ ID NO:3, and wherein the monoclonal antibody blocks binding of
PCSK9 to LDLR.
USP
8,859,741
1. An isolated monoclonal antibody that binds to PCSK9, wherein the
isolated monoclonal antibody binds an epitope on PCSK9 comprising at least one
of residues 237 or 238 of SEQ ID NO: 3, and wherein the monoclonal antibody
blocks binding of PCSK9 to LDLR.
共に4件の仮出願(2007年8月~2008年8月)を基礎とする米国出願から派生した特許
技術の背景 (Technical Background Info):
問題となった技術は単離されたモノクローナル抗体であり、非常に広範なクレームで機能的に表現されている。関連する薬剤としては特許権者AmgenのRepatha™(一般名:エボロクマブ)として知られており、その効用は血液中のLDLコレステロール(悪玉コレステロール)を低下させる幹細胞表面に発現するLDL受容体にPCSK9という酵素(悪者)が結合するのを防ぐ。PCSK9は当該LDL受容体と結合するとLDL受容体の機能を阻害し、LDLは幹細胞に吸収され血管の内側に蓄積し心筋梗塞や脳梗塞のリスクを高める。地裁とCAFCにおいて、当業者が不当に多大な実験を繰り返すことなくAmgen特許クレームの権利範囲に属する全ての形態に当業者が到達できるように明細書が記載されていないとして「実施可能要件」違反という理由でクレームは無効と判断された。通常ここで確定判決となるが最高裁が上告を受理した。(以下の説明図は、高山周子弁理士より)
