|
Amgen v. Sanofi事件 米国特許法第112条(a)項の明細書に課せられた「実施可能要件」 Oral Argument at US Supreme Court on Enablement under 35 U.S.C. 112(a) 2023年3月27日 Summarized by Tatsuo YABE – 2023-3-29 |
2023年3月27日、合衆国最高裁で表題の件に関する口頭審理が開催されました。米国特許法第112条(a)項の明細書に課せられた「実施可能要件」に関するもので1952年に立法されて最高裁が取り上げるのは初めてです。約1時間半に及ぶ口頭審理で、最初の40分が権利者側(Amgen)、次に30分が被疑侵害者側(Sanofi)、その後15分が米国政府側の主張で、残り数分は権利者側の反論です。以下当事者の主張をごく短くまとめています。最高裁判事と各当事者とのやり取りから判断すると112条(a)項の実施可能要件を判断する上での判例法(Minerals Separation 1916年の最高裁判決とIn re Wands 1988年CAFC判決)を変えることにはならないと思料します。事実、最高裁が途中で判例法に何か問題があるのか、一体全体当事者間にとっての法理論における争点は何なのかというような呆れた質問もしています。
以下にあるように問題となったAmgen特許のクレームは機能表現を用いたGenusクレームであり広範な権利範囲が規定されています。Amgen特許の明細書は380頁にも及びその中に26種の抗体とそのシーケンスが開示されています。しかし、これら抗体に共通するシーケンス(構造)が存在しないので当業者がこの長い明細書を参酌したところでこの広いクレームの権利範囲の全域にわたって発明を実施するには多大な実験(努力)が必要となるというSanofi及び政府側の主張が通ると予想します。依って、実施可能要件違反と判示した下級審(CAFC)の判決は維持されると考えます。
問題となった特許クレーム:
USP 8,829,165
1. An
isolated monoclonal antibody, wherein, when bound to PCSK9, the monoclonal
antibody binds to at least one of the following residues: S153, I154, P155,
R194, D238, A239, I369, S372, D374, C375, T377, C378, F379, V380, or S381 of
SEQ ID NO:3, and wherein the monoclonal antibody blocks binding of PCSK9 to
LDLR.
USP 8,859,741
1. An isolated monoclonal antibody that binds to PCSK9, wherein the isolated
monoclonal antibody binds an epitope on PCSK9 comprising at least one of
residues 237 or 238 of SEQ ID NO: 3, and wherein the monoclonal antibody
blocks binding of PCSK9 to LDLR.
共に4件の仮出願(2007年8月~2008年8月)を基礎とする米国出願から派生した特許
権利者側(Amgen)の主張:
明細書には26種の抗体とそのシーケンスが開示されているので、これら実施例を基礎としアミノ酸を置換するという作業でさらなる抗体を作ることは当業者にとってはルーチン作業である。従って、Amgenの明細書の開示内容に基づき当業者であればGenusクレームの権利範囲全域にわたって発明を実施可能となる。Amgenは384種の抗体を製造したが明細書が既に380頁にも及ぶのでそれら全てを記載しなかった。明細書の開示は当業者に十分なロードマップ(ガイダンス)となる。実施可能要件を判断する上で「当業者が明細書を参酌し不当に大変な実験(undue experimentation)をすることなく発明を実施できること」の「undue experimentation」を判断する上でWands要因(1988年のIn re Wands判決)を適用することには同意するが、その中で「技術の予見可能性(predictability)」という要因は抽象的であると考える。クレームの範囲が広ければ広いほど明細書の実施例がより充実していなければならないとは一概には言えない。それは技術分野によっても異なる。CAFCが判示した「クレームの権利範囲全体に対する実施可能要件(a full
scope of enablement)」を文言通りに解釈することには同意できない。即ち、クレーム権利範囲全体に対する妥当な(reasonable)実施可能要件というのがより適切である。発明を実施する上でどれだけの努力(cumulative efforts)が必要かに関して実験の数およびその期間は明細書に適切なガイダンスがある限り1年掛かろうと問題とはならない(例:車両Buickを一から製造する場合)。
被疑侵害者側(Sanofi)の主張:
112条(a)項で要求する実施要件を満たすには、クレームの権利範囲が広ければ広いほど、それに見合う多くの実施例が必要となる。クレームされた発明を実施するために当業者がどれだけの努力(cumulative efforts)が必要かという要因も考慮されなければならない。例)虹は多種の色で構成される。しかし当業者であれば複数の顔料(色)を用いてそれを組み合わせることによって所望する色を作れるだろう。そのような作業は妥当(reasonable)であり、「不当に多大な実験を要する(undue
experimentation)」の真逆と言えるだろう。George Winter氏(ノーベル賞受賞)の証言にあるようにAmgenの明細書の開示は当業者にGenusクレームの権利範囲を実施するための十分なロードマップとしては不十分である。Amgen特許のGenusクレームを統合するような構造が存在しない。即ち、26種の抗体に共通する構成が存在しないというのが問題である。この種の技術分野ではよくあることだ。Amgenが開示している26種の抗体に権利を求めるのであれば実施可能要件を満たすであろう。事実Sanofiが到達した抗体(AmgenのGenusクレームの権利範囲に包括される)の構成はAmgenの26種のものとは全く異なる、即ち、AmgenのGenusクレームは実施例に対して広すぎる。Amgenは「当業者にとってルーチン作業によってGenusクレームの発明を実施可能」と主張するがルーチン作業とは当業者がDNAを改変した試験マウスを使って、1000種ものアミノ酸を投与し、そこからPCSK9の適切な位置にバインドするものを見つけるという一から開発作業を進めるという意味ではない。
政府側の主張:
Sanofi側の主張に同意する。Genusクレームのアミノ酸のシーケンスがあればそれをレシピ―として実施可能となるかもしれない。しかしそのようなレシピ―は明細書に存在しない。CAFCの言う「クレームの権利範囲全体に対する実施可能要件(a full
scope of enablement)」とは確かにその文言通りに解釈するのではなく多少の融通を許可するものであり、それがreasonableと表現し(合理的に権利範囲全体・・・)そう解釈するべきである。権利者にとってはGenusクレームが実施可能要件を満たさないとしてもSpeciesを規定し、均等論の適用によって権利範囲を拡大解釈可能であろう。しかしAmgenの機能表現されたGenusクレームにおいては均等論の適用が難かもしれない。そもそも抗体という技術分野は一般的な特許法には馴染まないのかもしれない。その場合には裁判所に救済を求めても仕方ない、連邦議会に当該技術分野の例外規定の立法を要請するのが妥当である。
9人の最高裁裁判官(Justices)はそもそも技術の理解が乏しい故に質問がいったりきたりしています。私の印象としては「実施可能要件」に関して最高裁が新たな法理論を出してくるとは思えません。最高裁の判決は夏前にはでるでしょう。
↓ 以下で口頭審理が聞けます(特許関係の口頭審理@最高裁が聞けるのは年に一度位しかありません):https://www.supremecourt.gov/oral_arguments/audio/2022/21-757
事件の背景:
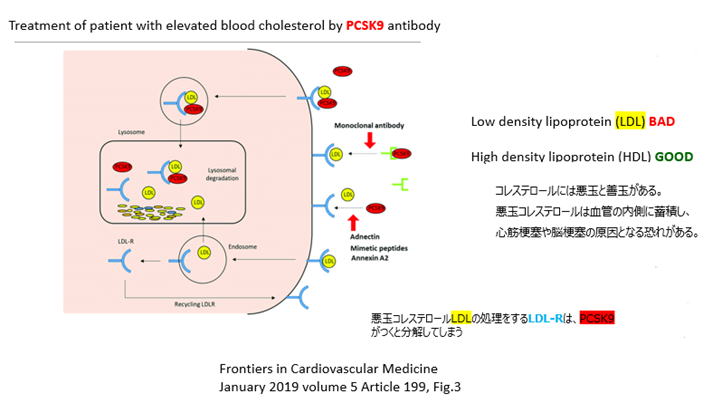
問題となった技術は単離されたモノクローナル抗体であり、非常に広範なクレームで機能的に表現されている。関連する薬剤としては特許権者AmgenのRepatha™(一般名:エボロクマブ)として知られており、その効用は血液中のLDLコレステロール(悪玉コレステロール)を低下させる幹細胞表面に発現するLDL受容体にPCSK9という酵素(悪者)が結合するのを防ぐ。PCSK9は当該LDL受容体と結合すると受容体の機能を阻害し、LDLは幹細胞に吸収され血管の内側に蓄積し心筋梗塞や脳梗塞のリスクを高める。地裁とCAFCにおいて、当業者が不当に多大な実験を繰り返すことなくAmgen特許クレームの権利範囲に属する全ての形態に当業者が到達できるように明細書が記載されていないとして「実施可能要件」違反という理由でクレームは無効と判断された。通常ここで確定判決となるが最高裁が上告を受理した。
(以下の説明図は、高山周子弁理士より)

References:
In re
Wands (Fed. Cir. 1988)
実施可能要件を満たすか否かを判断する上で、明細書を参酌し当業者が発明を実施する上で不当に多大な実験(undue experimentation)を要するか否かで判断する。この不当に多大な実験を要するか否かを判断するために衡量する項目をWands要因と称する(以下(1)-(8)を参照):
Those factual considerations, which have come to be known as the “Wands factors,” are: (1) the quantity of experimentation necessary, (2) the amount of direction or guidance presented, (3) the presence or absence of working examples, (4) the nature of the invention, (5) the state of the prior art, (6) the relative skill of those in the art, (7) the predictability or unpredictability of the art, and (8) the breadth of the claims.
Minerals
Separation v. Hyde (SUP CT: 1916)
("The
test of enablement is whether one reasonably skilled in the art could make or
use the invention from the disclosures in the patent coupled with information
known in the art without undue experimentation."). 要は、当業者がクレームされた発明を実施するのに「不当に大変な実験(undue experimentation)」を必要としないようにクレームされた発明が明細書に具体的に開示されていることを要求している。本最高裁判決において、発明された手法に関わる潜在的には無数のバリエーションを特許(明細書)で特定することは不可能であると述べています。
合衆国最高裁が裁量上告認めた(2022年11月4日)
http://www.tatsuoyabe.aki.gs/Amgen_v_Sanofi_cert_granted_2022_11_04.html